Disinfettanti e detergenti: conosci la differenza?
10 min read
L’uso di detergenti e disinfettanti è comune nella nostra vita quotidiana per mantenere l’igiene e il fine ultimo è la prevenzione. Un corretto uso è infatti alla base del benessere fisico, della prevenzione di alcune malattie infettive e della tutela di condizioni di vita anche di altri individui.
I termini detergenza e disinfezione nell’uso comune sono spesso erroneamente considerati sinonimi.
Con detergenza s’intende la proprietà di alcune sostanze, dette detergenti, di eliminare incrostazioni e in generale lo sporco di qualsiasi natura (liquidi, grasso, polvere o materiale organico). Con disinfezione si indica invece un’operazione in cui vengono impiegati agenti disinfettanti di natura chimica (disinfettanti organici o inorganici), fisica (ebollizione, vapore acqueo, calore o radiazioni) o meccanica (filtri) in grado di eliminare germi patogeni come batteri, virus e funghi.
Una buona norma è quella di far precedere un’attività di detersione a quella di disinfezione per evitare che residui di sporco possano comprometterne l’efficacia.
Detergenti
Introduzione
I detergenti e le loro caratteristiche sono regolati dalla legge al fine di tutelare la nostra salute e quella dell’ambiente. La normativa europea in vigore sui detergenti è il Regolamento (CE) N. 648/2004 del Parlamento Europeo e del Consiglio del 31 marzo 2004 e successive modifiche. La normativa definisce come «detergente» qualsiasi sostanza o preparato contenente saponi e/o altri tensioattivi destinato ad attività di lavaggio e pulizia.
I detergenti possono essere in qualsiasi forma (liquido, polvere, pasta, barre, pani, pezzi e soggetti ottenuti a stampo) ed essere commercializzati e utilizzati a livello domestico, istituzionale, o industriale.
Provate ad immaginare, per un momento, come sarebbe la nostra vita senza sapone, shampoo o bagnoschiuma. Siamo abituati a dare per scontato questi prodotti e la loro capacità detergente, ma la loro importanza è tale che senza di essi le attuali città non potrebbero esistere. Senza, sporcizia e malattie metterebbero a rischio la vita umana.
Un po’ di storia
Per secoli il genere umano ha sfruttato il potere detergente di alcune piante contenenti saponine. Ne sono esempi la saponaria (Saponaria officinalis) coltivata un tempo per il lavaggio della lana, l’albero del sapone (Sapindus saponaria) e in maniera particolare il suo frutto definito in inglese soapberry.
Esistono inoltre prove della produzione del sapone da parte di molte civiltà antiche. In siti di epoca babilonese risalenti a 5000 anni fa sono stati ritrovati cilindri d’argilla contenenti sapone e istruzioni per produrlo.
Documenti risalenti al 1500 a.C. mostrano che il popolo egizio produceva saponi a partire da grassi animali e cenere di legna, quest’ultima ottenuta dalla combustione di legna e torba.
Il popolo gallo usò un sapone fatto di grasso di capra e potassa (carbonato di potassio di formula K2CO3 che in acqua forma una soluzione alcalina) di cui è ricca la cenere di legna. Questo sapone può essere considerato un antenato del gel perché impiegato come una pomata per rendere rigidi i capelli.
Il sapone precursore di quello moderno è stato prodotto dal popolo arabo partendo dall’olio d’oliva e d’alloro e soda (carbonato di sodio con formula Na2CO3 contenuto nelle ceneri di particolari piante). Da queste materie prime ottennero un sapone profumato e colorato che si diffuse in tutto il mondo arabo.
L’azione detergente…
L’azione dei saponi si basa sul famoso principio chimico “il simile scioglie il simile”.
Sappiamo bene che grassi e oli non si sciolgono in acqua perché formati da molecole di natura diversa. Sostanze che hanno affinità e si sciolgono in acqua sono dette idrofile. Il termine idrofilia deriva dal greco hydros, “acqua”, e philia, “amicizia”.
Sostanze che al contrario non hanno affinità e non si sciolgono in acqua sono dette idrofobe. Il termine idrofobia, o idrofobicità deriva dal greco hydros, acqua, e fhobos, paura.
Tensioattivi
Lo sporco è costituito da residui di varia natura (polveri, fuliggine, ecc.) rivestiti da sostanze grasse, pertanto l’uso soltanto dell’acqua non è in grado di eliminarle. Abbiamo bisogno di sostanze che siano contemporaneamente affini al grasso in modo da eliminare lo sporco e all’acqua al fine di essere rimosse, una volta esplicata la loro azione, tramite risciacquo.
Questa caratteristica è tipica dei cosiddetti tensioattivi o emulsionanti, presenti nel sapone e nei detergenti, che hanno la capacità di ridurre la tensione superficiale dell’acqua aumentando il suo potere bagnante oltre a quella di rimuovere particelle di grasso ostacolandone la riaggregazione.
I tensioattivi hanno quindi doppia natura idrofila ed idrofoba. Sono composti organici le cui molecole presentano un gruppo idrofilo con una carica elettrica, positiva o negativa, detto testa e una lunga catena di atomi di carbonio che è idrofoba ed è detta coda. In virtù di queste caratteristiche la testa sarà propensa al contatto con l’acqua, la coda invece tenderà ad allontanarsi.
Ne consegue che molecole di tensioattivo si dispongono a formate delle strutture di forma sferica denominate micelle nelle quali, le code idrofobe si trovano all’interno e le teste idrofile che costituiscono la superficie della sfera si trovano a contatto con l’acqua.
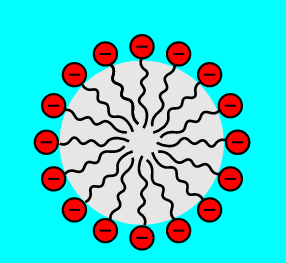
Quando grasso e unto entrano a contatto con le micelle dei tensioattivi vengono inglobati all’interno. Ogni micella ha una superficie carica e poiché cariche dello stesso segno si respingono, anche le micelle tenderanno a respingersi reciprocamente. Questo determina la dispersione delle molecole di sapone che portano via con sé le particelle d’unto una volta allontanate con i risciacqui.
Saponi sintetici
Fino agli anni ’50 del secolo scorso, la pulizia personale e il bucato erano quasi interamente affidati a saponi ottenuti da fonti naturali. In seguito detergenti sintetici, venduti in commercio con il nome di “detersivi”, li hanno soppiantati. A base di prodotti petrolchimici, anch’essi parimenti ai saponi, sono costituiti da una porzione idrofoba composta da una catena di atomi di carbonio ed una idrofila con un gruppo carico.
A seconda che sia positiva o negativa la carica elettrica sul gruppo idrofilo i detersivi si distinguono in anionici, cationici o anfoteri:
• Anionici: hanno una carica negativa. Sono i più diffusi. Hanno un alto potere schiumogeno e un elevato potere pulente su tutti i tipi di sporco. Sono soprattutto usati nei prodotti per il bucato, per il lavaggio delle stoviglie a mano e per la pulizia della casa.
• Cationici: hanno una carica positiva. Sono stati utilizzati principalmente negli ammorbidenti, ma sono presenti anche in alcuni detersivi per bucato.
• Anfoteri: sono in grado di assumere una carica elettrica positiva o negativa a seconda del tipo di soluzione nella quale si trovano. Sono utilizzati nei prodotti per la pulizia dei piatti per la loro delicatezza, potere schiumogeno e stabilità.
Esistono anche tensioattivi non ionici, cosiddetti perché non hanno carica elettrica. Vengono usati nei prodotti per il bucato, per il lavaggio delle stoviglie in macchina e nei coadiuvanti di lavaggio. In tal caso la parte idrofila della molecola è rappresentata dall’ossigeno in grado di formare dei legami con l’acqua.
Disinfettanti chimici
Introduzione
Quando si acquista un prodotto disinfettante è sempre presente un’etichetta che ne indica l’autorizzazione alla commercializzazione da parte del Ministero della salute ai sensi del regolamento (UE) n.528/2012 oppure la dicitura Presidio medico chirurgico ai sensi del D.P.R. 392/1998.
Il Ministero della salute può autorizzare la commercializzazione solo di prodotti contenenti ingredienti detti principi attivi autorizzati dall’Unione Europea. Questo prevede una preliminare verifica delle caratteristiche chimico fisiche, di sicurezza e di efficacia di ogni singolo principio attivo.
Le aziende che producono disinfettanti possono dare origine alla propria formulazione, la quale verrà sottoposta ad esami di laboratorio per verificarne l’efficacia.
L’azienda provvederà poi ad inoltrare domanda di autorizzazione al Ministero della Salute allegando un dossier con tutti gli studi preliminari. Tale dossier sarà sottoposto anche al parere dell’Istituto Superiore di Sanità. Solo in caso di parere favorevole il Ministero concederà l’autorizzazione.
Le etichette devono contenere: modalità di impiego, campo di applicazione, organismi bersaglio (es. batteri, virus) e le indicazioni che ne descrivono l’eventuale pericolosità e le precauzioni per l’uso.

Nascita della disinfezione
Nei tempi antichi era diffusa la credenza che demoni e spiriti maligni fossero la causa delle infezioni. Magia e stregoneria erano artifici diffusi per allontanarle.
Alcuni metodi naturali di disinfezione sono stati impiegati dagli egizi nel 3000 a.C. come l’uso di pece, catrame e resine. Fumi di sostanze chimiche (soprattutto zolfo) in fiamme erano usati per deodorare e disinfettare.
Ippocrate di Coo (460-377 a.C.) e la dottrina miasmatico umorale da lui concepita, rappresenta il più antico tentativo, nel mondo occidentale, di fornire una spiegazione dell’insorgenza delle malattie, superando la concezione superstiziosa, magica o religiosa.
Il termine miasma veniva utilizzato per indicare l’esalazione tossica conseguente ai fenomeni di putrefazione e responsabile di un ambiente malsano.
Il concetto moderno di infezione nacque nel XIX secolo con gli studi di Louis Pasteur, chimico e microbiologo francese che nel 1862 pubblica le sue scoperte su come i germi causano la malattia, che successivamente lo portano a sviluppare il processo di pastorizzazione.
Qualche anno prima nel 1847 un ostetrico Ignác Semmelweis ebbe una straordinaria intuizione. Egli dispose che tutti i medici e gli studenti che frequentavano il reparto ostetrico fossero obbligati a lavarsi le mani con una soluzione di cloruro di calcio prima di visitare le partorienti. Riuscì così ad ottenere un calo repentino della percentuale di febbri puerperali che le colpiva decimandole.
Successivamente Joseph Lister, seguendo le teorie di Pasteur, introdusse l’uso dell’acido fenico nel trattamento delle ferite riducendo significativamente l’incidenza della cancrena che le complicava con esiti mortali.
Robert Koch, qualche anno più tardi riuscirà a scoprire e dimostrare la responsabilità dei microrganismi nelle malattie infettive. Nel 1881 le sue ricerche e quelle dei suoi soci sulle proprietà disinfettanti di vapore e aria calda segnano l’inizio della scienza della disinfezione e sterilizzazione.
Come i disinfettanti agiscono…
Proteine e membrane biologiche, così come nell’uomo, anche per batteri e virus sono fondamentali componenti. I disinfettanti agiscono “colpendo” queste essenziali strutture.
Un primo meccanismo di disinfezione è la denaturazione delle proteine.
La denaturazione comporta la perdita della funzione originaria della proteina dovuta ad un cambiamento della struttura proteica nativa (conformazione tridimensionale originaria derivante dal suo ripiegamento).
Metodi fisici e chimici per denaturare le proteine sono l’uso di: acidi forti, basi forti, metalli pesanti, alcoli, ossidanti e riducenti (componenti dei disinfettanti chimici); calore, luce ultravioletta (disinfettanti fisici) e agitazione meccanica.
Un altro meccanismo è l’alterazione della membrana.
Come i disinfettanti agiscono sui virus

Virus
Un virus (dal latino vīrus, “veleno”) è un’entità biologica con caratteristiche di parassita obbligato ovvero in grado di replicarsi esclusivamente all’interno delle cellule degli organismi. I virus esistono in forma di particelle indipendenti e inattive, se non si trovano in fase di infezione o all’interno di una cellula infetta.
Le particelle virali, anche dette virioni, constano di due o tre parti: (I) il materiale genetico (DNA o RNA), costituito da lunghe molecole che trasportano le informazioni genetiche; (II) un rivestimento proteico, chiamato capside, che circonda e protegge il materiale genetico; e in alcuni casi (III) una membrana fosfolipidica, detta pericapside che circonda il rivestimento.
Valutiamo il caso specifico in cui l’azione dei disinfettanti rende inattivi i virus.
Denaturazione delle proteine dei virus
Alcuni disinfettanti chimici sono in grado di denaturare le proteine di cui è costituito il capside. Disinfettanti utili a tale scopo sono gli alcoli. Queste molecole hanno come caratteristica quella di avere un gruppo funzionale idrossilico –OH (ossigeno e idrogeno impegnati in un legame).
Un gruppo funzionale è una porzione della struttura di una molecola caratterizzata da specifici elementi che le conferisce una reattività tipica e simile a quella di altre molecole contenenti lo stesso gruppo.
Il gruppo –OH dell’alcol è in grado di formare legami a idrogeno (legame che si forma tra l’ossigeno di una molecola e l’idrogeno di un’altra) con gli amminoacidi, unità costitutive delle proteine. I nuovi legami sostituiscono i legami ad idrogeno preesistenti tra gli amminoacidi delle proteine inducendo il cambiamento strutturale.
Un altro esempio di disinfettanti in grado di distruggere il capside sono i composti ossidanti, come l’acqua ossigenata (H2O2), l’ipoclorito di sodio (la comune candeggina, NaClO) e il cloro. Questi composti sono in grado di ossidare i cosiddetti gruppi sulfidrilici –SH (formati dal legame di zolfo e idrogeno) ovvero ostacolare la formazione di legami (tra due atomi di zolfo detti ponti disolfuro −S−S−) tra amminoacidi essenziali per la stabilità della struttura proteica.
Alterazione della membrana dei virus
Altri disinfettanti agiscono invece disgregando la membrana, questo rende il virus incapace di attaccare le cellule.
Le membrane fosfolipidiche sono costituite da molecole, che hanno una porzione idrofila ed una idrofoba. Come i tensioattivi parte di saponi e detergenti, in ambiente acquoso queste molecole si raggruppano tra loro esponendo le parti idrofile all’acqua e tenendo vicine tra loro le parti idrofobe.
L’ uso di sostanze con molecole di natura simile alle membrane interferisce con la loro struttura sfaldandole dall’interno. Ciò implica che i detergenti possono agire da disinfettanti se il patogeno ha una membrana fosfolipidica, è il caso dell’ormai ben noto SARS-CoV-2.
Se vuoi conoscere ulteriori dettagli sui microbi e il mondo microscopico leggi l’articolo il mondo sotto i nostri occhi.

Sono Federica Carciola, laureata in chimica dei materiali presso l’Università degli Studi di Catania. Ho lavorato come analista chimico occupandomi di analisi chimico-fisiche su matrici ambientali. Adoro la lettura, i miei libri preferiti sono i gialli di Agatha Christie e Arthur Conan Doyle, che trattano i casi degli impareggiabili detective Hercule Poirot e Sherlock Holmes. Appassionata anche di cucina, la considero un piccolo laboratorio chimico nel quale applicare le mie conoscenze. Ho sviluppato un forte interesse per la scrittura ed ho deciso di combinare queste due passioni, scienza e scrittura, svolgendo attività di divulgazione scientifica.







