Fuochi d’artificio: l’uso della polvere da sparo per scopi ludici
6 min read
I fuochi d’artificio rappresentano uno spettacolo per grandi e piccini, capace di meravigliare al punto da lasciarci a bocca aperta. Nessuno rimane immune dalla combinazione di luci, colori ed effetti speciali di un fuoco pirotecnico. Accompagnano feste di paese, sagre e tradizionalmente i festeggiamenti per l’inizio di un nuovo anno. L’effetto visivo e sonoro è solitamente amplificato dall’ambiente soprattutto in presenza di specchi d’acqua, monumenti, piazze e vallate su cui si riflettono.

Scoperta e diffusione della polvere da sparo
La fabbricazione dei fuochi d’artificio è una vera e propria arte denominata pirotecnica. La parola deriva dal greco pyr (fuoco) e tecné (tecnica) e sta a significare tecnica del fuoco. Nasce in Cina intorno all’800 a seguito della scoperta della polvere da sparo, denominata anche polvere nera o polvere pirica.
La scoperta fu del tutto casuale, alcune leggende narrano che gli alchimisti cinesi fossero alla ricerca dell’elisir dell’immortalità, quando scoprirono invece la miscela esplosiva seguendo il concetto di serendipity. (Per saperne di più sulla storia della serendipità ed il suo ruolo nella scoperta scientifica leggi l’articolo cos’è la serendipity).
La polvere da sparo fu inizialmente impiegata per scopi militari, nonostante gli usi, all’epoca, fossero molto rudimentali e i primi ordigni bellici pirotecnici venissero lanciati a mano o con catapulte. Fin dal VI secolo i cinesi costruirono esplosivi e le loro tecniche si diffusero in Arabia nel VII secolo. Ad introdurre la polvere da sparo in Europa furono i popoli mongoli durante la loro invasione dell’Ungheria sotto la guida di Ögödei, intorno al 1241.
La sostanza si diffuse rapidamente con il nome di “neve cinese” o “sale cinese” e anche la sua conoscenza fu tramandata celermente. Nel 1245 il filosofo e alchimista inglese Ruggero Bacone riportò nella sua epistola “De secretis operibus artis et naturae, et de nullitate magiae” la formula della polvere nera. La composizione indicata è pressoché quella ancora in uso oggi (75% nitrato di potassio KNO3 anche detto salnitro, 13% di carbone di legna polverizzato, 12% di polvere di zolfo).
L’uso ludico della polvere da sparo
Esempi di uso puramente ludico della polvere pirica risalgono al basso medioevo (XIII-XV secolo). Veniva impiegata per accompagnare sacre rappresentazioni e durante esecuzioni teatrali per raffigurare scoppi, fiamme e bagliori. Nel 1379 a Vicenza in occasione dell’Ascensione venne messo in scena il volo della colomba: un fuoco sulla corda che dalla torre del Palazzo vescovile volava verso l’effigie di Maria e degli apostoli celebrando la riconciliazione tra Scaligeri e Visconti.
Tra il 1340 e il 1348 sorsero in Germania ad Augusta, Spandau e a Liegnits le prime fabbriche di fuochi pirotecnici a scopo di spettacolo. Dall’inizio del XVII secolo furono due le principali scuole di pirotecnica in Europa: la scuola italiana dei Ruggeri a Bologna, famosa per la spettacolarità dei fuochi nei quali venivano usati degli scenari trasparenti o variamente colorati; la scuola di Norimberga dei Clamer, nota per la omonima tecnica di sparo aerea che veniva usata.
Tra il XVII e XVIII secolo feste popolari e avvenimenti importanti in Europa cominciarono ad essere abbelliti dagli spettacoli pirotecnici i quali però non prevedevano l’utilizzo di fuochi colorati. I primi fuochi colorati risalgono al 1785 quando Claude Louis Berthollet introdusse l’uso del clorato di potassio nella miscela dei fuochi. Ebbe così inizio la pirotecnica moderna destinata, con l’utilizzo di altri metalli nelle miscele di polveri, a fornire una molteplicità di effetti luminosi e brillantezza di colori.
La chimica dei fuochi d’artificio
La reazione chimica alla base di qualunque fuoco d’artificio è la combustione; reazione che prevede l’ossidazione di un combustibile da parte di un comburente. Un esempio tipico di combustione è quello che avviene in un camino quando carta o legna bruciano.
La differenza con una classica combustione sta però nel fatto che l’ossigeno non venga fornito dall’aria, bensì da uno dei componenti solidi della miscela stessa. Nel caso della polvere pirica è il nitrato di potassio che funge da comburente, mentre carbone e polvere di zolfo agiscono da combustibile. Durante la reazione chimica il combustibile cede elettroni al comburente, formando legami con l’ossigeno. I legami che si instaurano tra i prodotti della reazione sono più stabili di quelli che caratterizzavano i reagenti, per tale motivo in seguito all’ignizione (innesco) la reazione avviene molto rapidamente, liberando energia sotto forma di calore.
La combustione della polvere da sparo produce tutta una serie di specie gassose, come ossigeno, idrogeno, carbonato di potassio, solfato di potassio, biossido di carbonio (o anidride carbonica) e monossido di carbonio. La veloce espansione determina l’esplosione che lancia in ogni direzione i materiali luminosi, creando i vari giochi di forme e colori dei fuochi d’artificio.
Altri esempi di comburenti impiegati sono: perclorato di potassio, nitrato di bario, nitrato di potassio, nitrato di sodio. I combustibili usati sono invece: alluminio pirotecnico, gomma acaroide (ottenuta dalla corteccia di albero), magnesio in polvere, resine; zucchero (per bombe fumogene), silicio e boro (utilizzati soprattutto per le micce).
Da dove deriva il colore dei fuochi d’artificio….
I colori dei fuochi d’artificio sono ottenuti aggiungendo come additivo alla polvere nera un sale chimico; ovvero un composto, contenente elementi metallici (responsabili delle emissioni di luce), elettricamente neutro costituito dall’insieme di ioni negativi detti anioni e positivi detti cationi. Un esempio tipico di sale chimico è il cloruro di sodio, il comune sale da cucina.
La luce deriva essenzialmente da due meccanismi: incandescenza ed emissione atomica.
Come detto precedentemente l’esplosione provoca il rilascio di una quantità elevata di energia sotto forma di calore. Le particelle solide della polvere sono portate ad alta temperatura dal calore liberato dall’esplosione ed emettono per incandescenza un ampio spettro di radiazione.
L’emissione di una radiazione è un fenomeno secondo cui una sostanza emette energia sotto forma di onde, ne sono esempi la luce visibile, cosiddetta perché percepita dal nostro occhio, i raggi ultravioletti e quelli infrarossi.
Ogni elemento chimico ha uno spettro di emissione proprio, caratterizzato da valori di lunghezza d’onda (e quindi colore) ben definiti. Molti atomi metallici, una volta eccitati fornendo loro energia, emettono radiazioni elettromagnetiche che cadono nella regione del visibile, cioè con lunghezze d’onda comprese tra 380 e 780 nanometri, in tali casi i sali chimici conferiscono colorazione alla fiamma.
Principali sali chimici usati per ottenere il colore
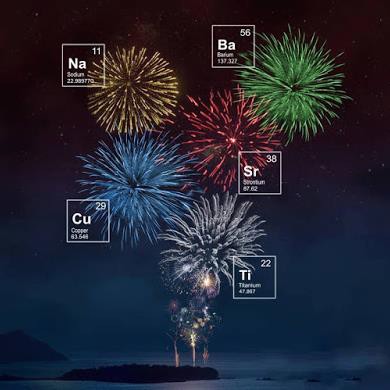
Specifici sali chimici sono impiegati in funzione del colore che si vuole ottenere: per ricavare il rosso sono usati carbonati e ossalati di stronzio; il verde si ottiene mediante i carbonati di bario; carbonati e ossalati di sodio sono usati per il giallo; per il colore blu gli ossidi di rame; il viola si ottiene invece da una miscela di cloruri di stronzio e di rame.
Sostanze quali antimonio o magnesio formano una luce bianca. Le particelle di ossido di magnesio, ad esempio, raggiunta una temperatura di 3.000 °C, producono una luce bianca molto intensa e brillante (il magnesio veniva utilizzato a tale scopo anche in campo fotografico per realizzare il classico lampo). Analoghi lampi si possono ottenere con miscele di perclorato di potassio e alluminio.
I colori dei fuochi d’artificio possono essere creati anche usando sostanze di origine animale o vegetale. La gommalacca (una secrezione prodotta da un insetto dell’ordine degli emitteri detto kerria lacca o cocciniglia della lacca) è usata nelle composizioni rosse, mentre per quelle azzurre e viola si usa il sughero.
Per approfondire:

Sono Federica Carciola, laureata in chimica dei materiali presso l’Università degli Studi di Catania. Ho lavorato come analista chimico occupandomi di analisi chimico-fisiche su matrici ambientali. Adoro la lettura, i miei libri preferiti sono i gialli di Agatha Christie e Arthur Conan Doyle, che trattano i casi degli impareggiabili detective Hercule Poirot e Sherlock Holmes. Appassionata anche di cucina, la considero un piccolo laboratorio chimico nel quale applicare le mie conoscenze. Ho sviluppato un forte interesse per la scrittura ed ho deciso di combinare queste due passioni, scienza e scrittura, svolgendo attività di divulgazione scientifica.